近年来,基于生物标志物指导的新型药物不断发展,如针对ESR1突变的新型选择性
研究分析了HR+/HER2−晚期乳腺癌患者一线至三线治疗阶段,组织活检(TBx)和液体活检(LBx)样本中基因改变(GA)的检出率,包括ESR1突变、PIK3CA突变、AKT1突变、PTEN突变及PTEN纯合拷贝缺失,并按循环肿瘤DNA(ctDNA)肿瘤分数(TF)进行分层分析。研究的主要终点是真实世界中的无进展生存期(rwPFS)和总生存期(rwOS),次要终点是治疗中断时间(rwTTD)。
共5780例患者接受TBx,1670例接受LBx。其中,1002例(17.3%)TBx样本和503例(30.1%)LBx样本检测到ESR1突变;2442例(42.2%)TBx样本和564例(33.8%)LBx样本检测到PIK3CA突变;289例(5%)TBx样本和70例(4.2%)LBx样本检测到AKT1突变;602例(10.4%)TBx样本和41例(2.5%)LBx样本检测到PTEN改变(突变或缺失),TBx样本中最常见的PTEN改变为PTEN纯合拷贝缺失,占所有TBx样本的4.1%,而LBx样本中仅4例(0.2%)检测到PTEN纯合拷贝缺失。
在一线、二线和三线的治疗起始阶段(治疗开始的前后60天内)采集的TBx样本中,ESR1突变检出率分别为8.1%(175/2154)、27.1%(73/269)和33.3%(72/216)。一线治疗起始阶段检测到ESR1突变的患者,更倾向于接受AI以外的内分泌治疗(ET)(TBx:p<0.001,LBx:p=0.006)。与ESR1野生型患者相比,在二线和三线治疗起始阶段检测到ESR1突变的患者既往使用AI治疗的比例更高(图1A)。在一线、二线和三线治疗起始阶段采集的LBx样本中,ESR1突变检出率分别为10.4%(30/288)、37.6%(74/197)和38.7%(46/119)(图1B)。
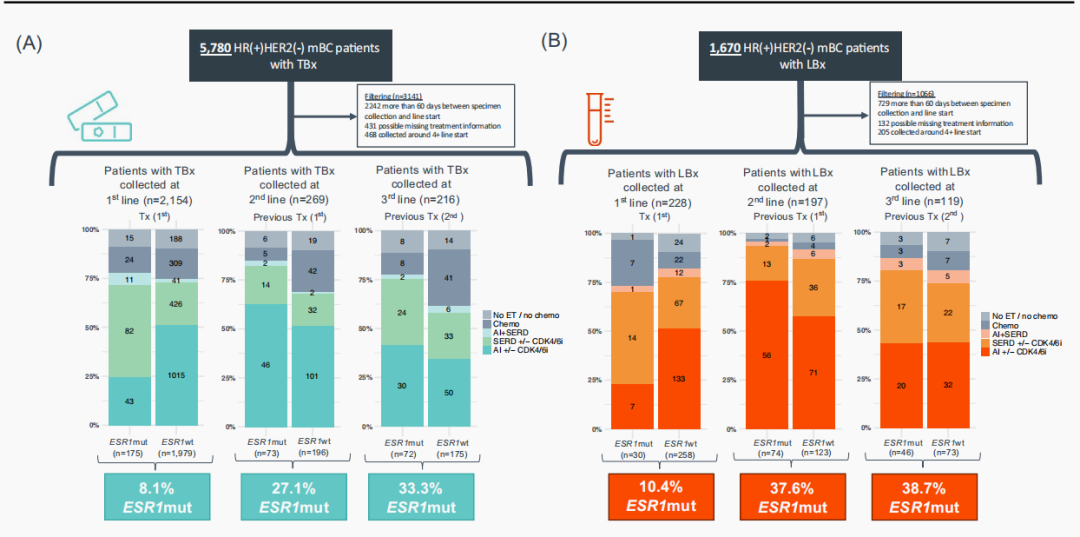
图1 一线至三线治疗期间TBx(A)与LBx(B)样本中ESR1突变的检出率
在一线、二线和三线治疗起始阶段采集的TBx样本中,PI3K/AKT通路改变检出率分别为55.1%(1186/2154)、48.3%(130/269)和54.6%(118/216)。而同样阶段采集的LBx样本中,该通路改变的检出率分别为38.2%(110/2154)、49.7%(98/269)和46.2%(55/216)。其中,一线治疗中分别有58.8%(TBx)和42.7%(LBx)患者检测到至少一种基因改变,而后线治疗中这一比例升至62%~71%,这主要归因于获得性ESR1突变的出现。此外,PTEN纯合拷贝缺失在TBx样本中的检出率(3.3%~5.6%)高于LBx(0%~1.0%)(图2A)。
根据ctDNA TF(≥1%与<1%)评估各类基因突变的发生率,发现ctDNA TF≥1%的LBx样本中,基因突变的检出率显著高于ctDNA TF<1%的样本(一线:p<0.001;二线:p<0.01;三线:p<0.05)(图2B)。
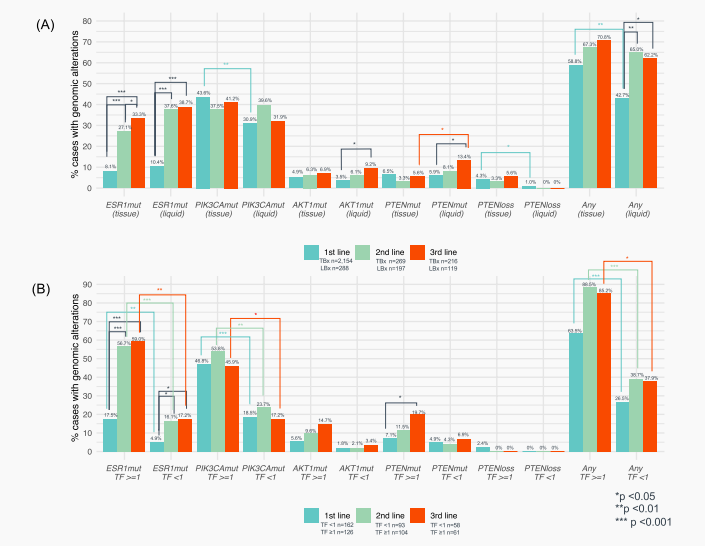
图2 一线至三线治疗期间TBx和LBx中ESR1突变和PI3K/AKT通路基因改变的检出率(2A)以及LBx中根据ctDNA TF分层的结果(2B)
在一线、二线和三线治疗起始阶段采集的TBx样本中,同时检测到ESR1突变和PI3K/AKT通路基因改变的比例分别为4.4%(95)、8.2%(22)和17.1%(37)(图3A)。PI3K/AKT通路改变方面,同时发生PIK3CA突变与PTEN缺失(突变或缺失)的患者,在一线、二线和三线治疗组分别为4.0%(85)、1.8%(5)和4.6%(10);PTEN纯合拷贝缺失作为唯一检测到的基因改变,分别见于第一线3.2%(68)、第二线2.2%(6)和第三线3.2%(7)的患者;PIK3CA与AKT1的共突变在一线和二线治疗的检出率为0.4%,而在三线的检出率为0%;此外,AKT1突变与PTEN改变呈互斥关系(图3B)。
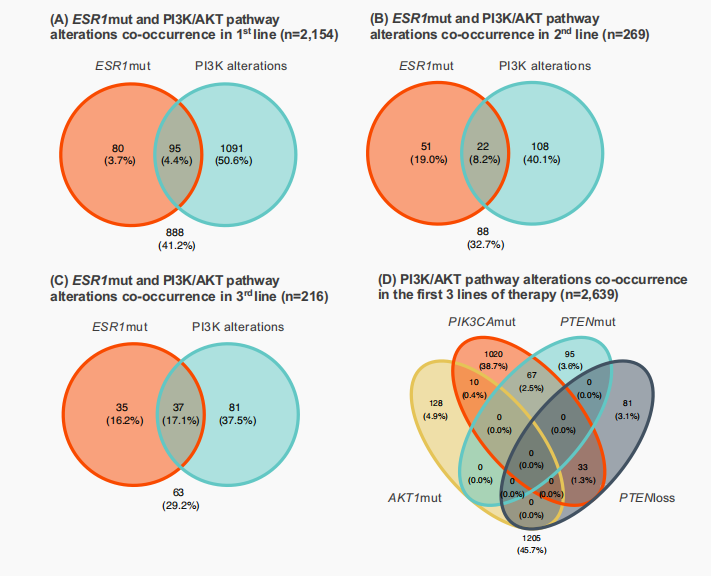
图3 一线至三线治疗的患者中通过TBx检测到ESR1突变和PI3K/AKT通路基因改变的共同检出率
共921例在一线治疗起始阶段采集的TBx样本被纳入治疗结局分析,其中62.2%的患者接受一线AI+CDK4/6抑制剂治疗,37.8%接受一线氟维司群+CDK4/6抑制剂治疗。81例(8.8%)患者在基线检测到ESR1突变,其中27.2%的患者一线选择了AI+CDK4/6抑制剂治疗,72.8%选择了氟维司群+CDK4/6抑制剂治疗。ESR1野生型患者与ESR1突变患者的中位年龄分别为63岁和65岁。多数患者的ECOG评分为0分(51.5%),32.0%患者存在骨转移。ESR1突变患者中,多数(61.7%)既往接受过AI或他莫昔芬辅助内分泌治疗,而ESR1野生型患者中仅34.4%接受过辅助内分泌治疗。
在接受AI+CDK4/6抑制剂一线治疗的573例患者中,与ESR1野生型患者相比,ESR1突变患者的真实世界治疗中断时间(rwTTD)显著更短(7.2个月 vs 18.8个月,HR=2.84,p<0.0001);真实世界无进展生存期(rwPFS)同样显著更短(8.1个月 vs 21.4个月,HR=1.93,p=0.011);真实世界总生存期(rwOS)呈现更差的趋势(33.9个月 vs 53.5个月,p=0.436,未达统计学显著性)(图4A–C)。然而在接受氟维司群+CDK4/6抑制剂一线治疗的患者中,ESR1突变与野生型患者的rwTTD(p=0.748)、rwPFS(p=0.16)及rwOS(p=0.278)均无显著差异(图5A–C)。此外,在接受AI+CDK4/6抑制剂治疗的患者中,检出的特定ESR1突变类型似乎未影响其生存结局(图4D)。值得注意的是,3例携带ESR1 Y537S突变且接受氟维司群+CDK4/6抑制剂治疗的患者,其rwTTD和rwPFS明显缩短(图5D)。
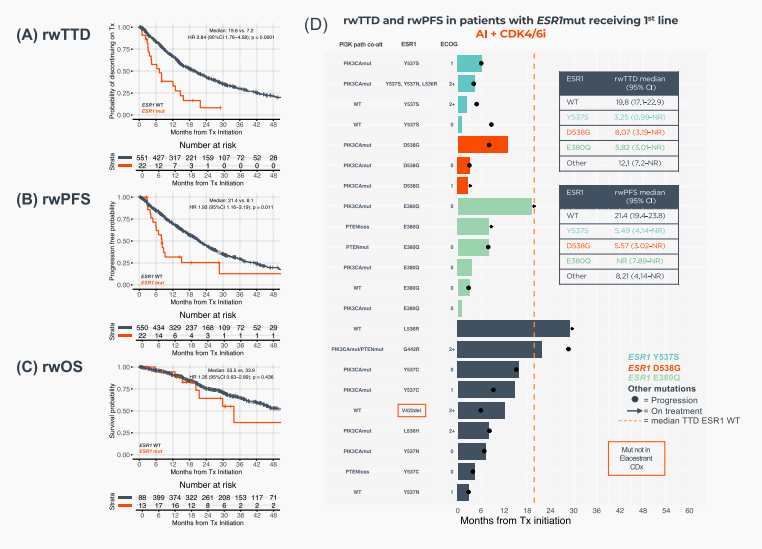
图4 HR+/HER2−晚期乳腺癌患者在一线使用AI+CDK4/6抑制剂治疗时,根据TBx检测到ESR1突变情况的临床结局 (A) rwTTD (B) rwPFS (C) rwOS
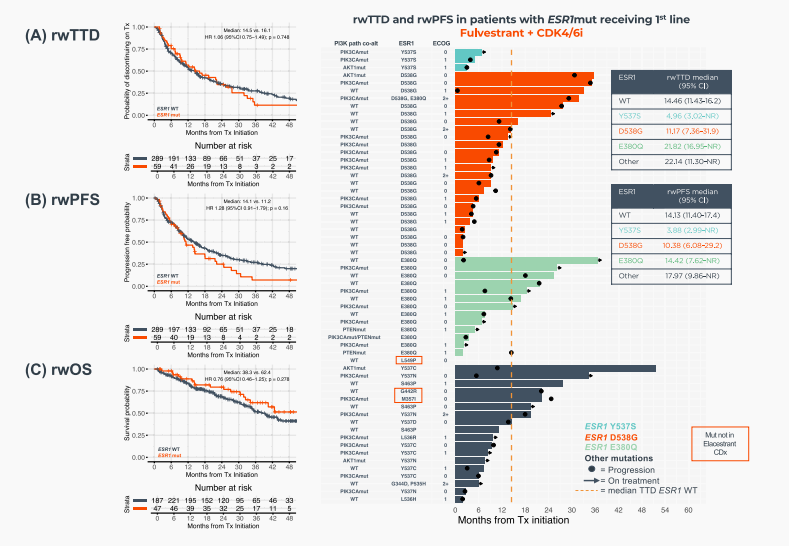
图5 HR+/HER2−晚期乳腺癌患者在一线使用氟维司群+CDK4/6抑制剂治疗时,根据TBx检测到ESR1突变情况的临床结局 (A) rwTTD (B) rwPFS (C) rwOS
本研究表明,在一线治疗中,约60%的HR+/HER2−晚期乳腺癌患者经TBx或ctDNA TF≥1%的LBx检测到ESR1突变或至少一种PI3K/AKT通路改变(包括PIK3CA突变、AKT1突变、PTEN突变或缺失),而在ctDNA TF<1%的LBx样本中,基因改变的发生率为26.5%。在一线治疗中检测ESR1突变,有助于支持AI与SERD治疗选择的临床决策,尤其适用于内分泌治疗耐药的患者。ESR1突变的发生率随治疗线数增加而升高,在LBx样本中尤为明显,三线治疗中ctDNA TF≥1%的LBx样本中ESR1突变发生率达59%。本研究建议在新发/复发晚期乳腺癌确诊时,采用TBx进行全面基因组分析,并在后续治疗中采用LBx样本检测获得性基因改变。当LBx中ctDNA TF<1%且未检测到基因改变时,应考虑进行TBx。
参考文献
Bhave MA, Quintanilha JCF, Tukachinsky H, et al. Comprehensive genomic profiling of ESR1, PIK3CA, AKT1, and PTEN in HR(+)HER2(-) metastatic breast cancer: prevalence along treatment course and predictive value for endocrine therapy resistance in real-world practice. Breast Cancer Res Treat. 2024;207(3):599-609.
审批编号:CN-173387
有效期至:2026-05-28
本文由阿斯利康提供,仅供医疗卫生专业人士参考,不可用于推广目的
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)